商家描述
售后服务
产品评价(0)
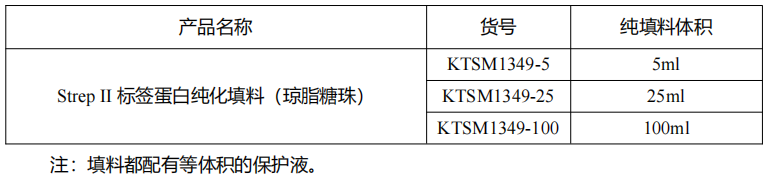
Strep II 标签蛋白纯化填料(琼脂糖珠)
产品说明康体生命改造的配体 Streptactin-XT 偶联到琼脂糖珠上,可作为一种高亲和力的层析填料,
用于纯化融合 Strep II 标签(W-S-H-P-Q-F-E-K)或 TwinStrep II 标签(S-A-W-S-H-P-Q-F-E-K-G-
G-G-S-G-G-G-S-G-G-S-A-W-S-H-P-Q-F-E-K)的蛋白。 Streptactin-XT 配体与目标蛋白的亲和力
在 nM~pM 范围,无需孵育,极高的亲和力仅需一个纯化步骤即可获得高纯度的蛋白质。
该填料兼容多种洗涤剂、变性剂和其他添加剂。样品中低于 50μM 的 D-生物素不会影响目的
蛋白的结合。与目的蛋白结合后可用洗脱液(Elution buffer of Streptactin-XT,即 E-XT)可逆
洗脱。再生液(Regeneration buffer of Streptactin-XT,即 R-XT)再生 10 次后,仍不影响性能。

产品应用
本产品常用于从多种表达系统中高效快速地纯化融合 Strep II 标签/ TwinStrep II 标签的蛋白。
也适用于免疫沉淀(IP)、免疫共沉淀(CoIP)、染色质免疫沉淀(CHIP)、RNA 结合蛋白免疫沉淀
(RIP)等实验。
产品属性
珠子直径:~45-165 μm(4%交联琼脂糖珠)
配体:Streptactin-XT
配体偶联量:8 mg/ml
介质占比:50%
耐压:0.3 MPa
载量:3-5mg Strep II 标签蛋白/ml 介质
保护液: 1×PBS,含 50% 甘油和 0.03% NaN3
储存条件:2~8℃,避免冻存,有效期 1 年
推荐使用溶液

操作说明
离心管纯化
1.平衡
1)取适量填料加入离心管中,1000 ×g 离心 3 分钟弃上清;
2)加入提前预冷的 5 倍介质体积的 Dilution/Wash buffer,4℃,1000 ×g 离心 3 分钟,去掉
上清,重复 2 次。
2.结合蛋白
1)将准备好的蛋白样品,加入平衡后的填料中,混匀;
2)4℃ 孵育 10 分钟(可选步骤);
3)4℃,1000 ×g 离心 3 分钟,去掉上清。
3.洗杂
1)加入 5 倍介质体积的 Dilution/Wash buffer 重悬填料;
2)4℃,1000×g 离心 3 分钟,去掉上清,重复 2-3 次
4.洗脱结合蛋白
用 3 倍柱体积的 E-XT 洗脱目的蛋白,分管收集;或第一次加入 0.6 倍柱体积的洗脱液,
收集并标记为 E1,第二次加入 1.6 倍柱体积的洗脱液,收集并标记为 E2,第三次加入 0.8 倍柱
体积的洗脱液,收集并标记为 E3。
重力柱纯化
1.装柱
1)取一支空柱,将下垫片压制柱底部并压实,用去离子水冲洗垫片,待水从下出口流出
后马上关闭下出口。
2)取适量 填料混悬液(保护液与填料比是 1:1),打开下出口流干保护液。
2.平衡:加入 5 倍柱体积的 Dilution/Wash buffer,平衡 3 次。
3.上样:将样品加入平衡好的柱子中,样品保留至少 2-10 分钟, 保证样品和介质充分接
触,可以多次上样增加结合效率。
【注】注意收集流出液,用于后续 SDS-PAGE 检测蛋白的结合情况。
4.平衡/洗杂:用 5 倍柱体积的 Dilution/Wash buffer 洗杂 1~3 次,去除非特异性结合的杂
蛋白,收集每次的洗杂液。
5.洗脱:用 3 倍柱体积的 E-XT 洗脱目的蛋白,分管收集;或第一次加入 0.6 倍柱体积的
洗脱液,收集并标记为 E1,第二次加入 1.6 倍柱体积的洗脱液,收集并标记为 E2,第三次加
入 0.8 倍柱体积的洗脱液,收集并标记为 E3。
中压层析柱纯化
1.装柱
1)用去离子水冲洗层析柱底筛板与接头,确保柱底筛板上无气泡,关闭柱底出口,并在
柱底部留出 1~2 cm 的去离子水。
2)将填料悬浮起来,小心的将浆液连续地倒入层析柱中。用玻璃棒沿着柱壁倒入浆液可
减少气泡的产生。
3)打开层析柱底部出口,开启泵,使其在设定的流速下进行。最初应让缓冲液缓慢流过
层析柱,然后缓慢增加至最终流速,这样可避免液压对所形成柱床的冲击,也可以避免柱床形
成的不均匀。如果达不到推荐的压力或流速,可以用你所使用泵的最大流速,这样也可以得到
一个很好的装填效果。当柱床高度稳定后,在最后的装柱流速下至少再上 3 倍柱床体积的去离
子水,标上柱床高度。
【注】在随后的色谱程序中,不要超过最大装柱流速的 75%。
2.平衡:使用至少 5 倍柱床体积的 Dilution/Wash buffer 平衡色谱柱。
3.上样:利用泵或样品环上样。
注意:样品的粘度增加使得即使上样体积很少,也会导致层析柱很大的反压。上样量不要超
过柱子的结合能力。大量的样品体积也可能造成很大的反压,使得进样器更难使用。
4.平衡/洗杂:用 Dilution/Wash buffer 冲洗柱子,直到紫外吸收达到一个稳定的基线(一
般至少 10~15 个柱体积)。
5.洗脱:使用 5~10 倍柱体积的 E-XT 洗脱,分管收集洗脱液,即目的蛋白组分。
再生和保存
1.再生
1)5 倍柱体积的 Dilution/Wash buffer 清洗柱子;
2)6 倍柱体积的 R-XT 再生液再生后立刻去除 R-XT,并立即加入 8 倍柱体积的
Dilution/Wash buffer 清洗 1~2 次;
注:也可以选择用新配置的 10 mM 氢氧化钠溶液进行再生。
2.保存
填料再生清洗后保存在等体积的 Dilution/Wash buffer 液中,2~8℃保存。
产品信息
声明:本产品仅供科学研究使用,不能用于人、动物的医疗或诊断程序等。
 会员登录
会员登录.getTime()%>)
 购物车()
购物车()

 成功收藏产品
成功收藏产品